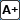Questi scienziati, che per le loro ricerche conseguirono il premio Nobel, scoprirono i raggi X e la radioattività naturale; sul loro sviluppo sono fondate la moderna radioterapia a fasci esterni e la brachiterapia, che utilizza le radiazioni emesse da particolari sorgenti poste "vicino" alla lesione da curare.
In Canada all'inizio degli anni '50 diviene disponibile un apparecchio che sfrutta la radioattività emessa dal Cobalto 60, isotopo radioattivo con tempo di dimezzamento di circa 5 anni, che emette raggi gamma di 1.25 MeV.
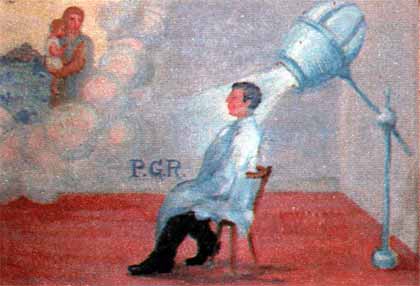
Ex voto del 1955 inviato da un "paziente guarito dal cancro con Cobaltoterapia".
Santuario della Madonna del Monte di Cesena
Negli stessi anni si lavora ad una macchina che possa produrre raggi x ad alta energia senza l'uso di sostanze radioattive e nel 1953 la Brown Boveri Co. in Svizzera disegna la prima macchina acceleratrice di elettroni su un'orbita circolare, con energia di 31 MeV per uso radioterapico.
Questa macchina fu installata nella metà degli anni '50 a Zurigo, ad Oslo e negli anni 60 in Italia a Firenze, Milano e Roma.
Betatrone 31 Mev della Brown Boveri
Firenze 1960-1993
Negli ultimi 20 anni del secolo XX lo sviluppo tecnologico in campo radioterapico è stato enorme e molto rapido, potendosi avvalere anche dell'ausilio dell'informatica.
Parallelamente alla radioterapia a fasci esterni anche la brachiterapia fa grandi passi in avanti: si ricercano radioisotopi in sostituzione del radium e modalità di trattamento che offrano maggiore protezione per il paziente e l'operatore.
Nascono così tecniche, prima manuali e poi meccaniche, di inserimento da lontano delle sorgenti sia a contatto che all'interno dell'organo da curare. Prima vengono usati il Cobalto 60 nel Catetron e il Cesio 137 nel Curietron.

Sagittaire della C.G.R.
Installato alla fine degli anni '70
Appena il Cesio 137 è stato disponibile in piccole sfere, contenute in sonde, entra nella pratica clinica il Selectron che inserisce l’isotopo sotto il controllo del computer con un inserimento di tipo pneumatico. L’Iridio
La possibilità di misurare le radiazioni ionizzanti e di conoscerne la distribuzione all’interno del corpo umano ha accompagnato lo sviluppo della radioterapia con la possibilità di trarne il grande beneficio della guarigione da una patologia tumorale accompagnata dalla riduzione al minimo degli effetti collaterali.
Inoltre lo studio degli effetti delle radiazioni sui tessuti animali e umani, sani e tumorali, ha permesso la identificazione di modalità di frazionamenti della dose utili a distruggere determinati tumori con la morte delle cellule malate senza la contemporanea morte delle cellule sane.
 |  |
dei raggi X in radioterapia
Radioterapia convenzionale a fasci esterni (fotoni X di alta energia ed elettroni veloci)
Gli attuali acceleratori lineari, dotati di collimatori multilamellari (= elevato numero di lamelle schermanti dello spessore da
Terapia conformazionale: distribuzione della dose “conforme” al volume da irradiare, ricostruito tridimensionalmente su immagini di tomografia computerizzata (TC). In alcuni casi è possibile ricorrere all’ausilio di immagini radiologiche più idonee alla definizione del volume da trattare quali la risonanza magnetica (RMN) o la tomografia a emissione di positroni (PET). Grazie all’impiego delle lamelle schermanti, ciascuna dotata di motore proprio, e pertanto mosse indipendentemente fra di loro in maniera automatica e sotto controllo informatico, è possibile modificare il profilo del fascio di radiazioni al fine di proteggere in maniera ottimale i tessuti sani circostanti e di ridurre conseguentemente gli effetti collaterali. La terapia conformazionale costituisce oggi lo standard dei trattamenti.
Terapia ad intensità modulata (IMRT) costituisce una evoluzione delle tecniche conformazionali ed è basata sempre sull’utilizzo dei collimatori multilamellari con lo scopo di erogare dosi variabili su volumi irregolari. Durante ogni singola seduta i campi diversamente conformati vengono accesi e spenti in modo da modulare l’intensità della dose che viene erogata nel contesto del volume da trattare. Tale terapia offre vantaggi in situazioni cliniche che richiedono la esposizione di volumi irregolari e complessi in stretta contiguità con organi critici.
Stereotassi: tecnica che permette di somministrare un’elevata dose di radiazioni, in una singola o in poche sedute ad un piccolo volume, con risparmio del tessuto sano circostante. Con l’ausilio di una ancora più accurata immobilizzazione può essere eseguita con gli acceleratori lineari su bersagli sia cranici che extracranici. Sono disponibili attrezzature dedicate quali il Cyberknife e il Gammaknife. Il Cyberknife è un acceleratore robotizzato in grado di eseguire trattamenti stereotassici sia cranici che extracranici; il Gammaknife, dotato di un casco con 201 sorgenti Co60, risulta dedicato esclusivamente a stereotassi cranica. I trattamenti in stereotassi non possono essere estesi a tutti i pazienti ma hanno una indicazione ben definita in alcune patologie e in particolari situazioni cliniche.
Radioterapia immagine guidata (IGRT) La accresciuta precisione dei trattamenti tridimensionali radioterapici ha sviluppato la necessità di controllo più accurato della ripetibilità del trattamento in ogni singola seduta mediante la identificazione della esattezza del posizionamento della sede da trattare. Sistemi di imaging tridimensionali integrati con gli acceleratori sono oggi disponibili nelle sale di terapia con lo scopo di garantire con sempre maggiore precisione il controllo dei trattamenti.
Radioterapia intraoperatoria: dopo la rimozione del tumore da parte del chirurgo, è possibile irradiare il letto operatorio con fasci di elettroni accelerati prodotti da acceleratori dedicati che possono essere alloggiati in sala operatoria.
Viene così definita una tecnica radioterapica che utilizza le radiazioni prodotte da tutte le particelle non elementari fatte di quark, dette adroni (radiazioni corpuscolate ad alto LET). Per la maggiore lesività biologica e le modalità particolari di cessione di energia tali trattamenti hanno indicazioni molto selettive e in ambito di studi clinici. L’adroterapia richiede acceleratori di particelle più grandi e potenti di quelli oggi usati negli Ospedali per la Radioterapia convenzionale. Si tratta di acceleratori per lo più circolari, detti ciclotroni e sincrotroni . I protoni, i neutroni e gli ioni di elio e carbonio sono gli adroni più noti. Presso la Università di Catania da qualche anno è attivo un acceleratore di protoni, dedicato alla ricerca fisica, in grado di produrre fasci da 60 MV adatti al trattamento della patologia tumorale orbitaria. E' da poco attivo a Pavia il primo centro clinico in Italia con disponibilità di protoni e ioni di carbonio.
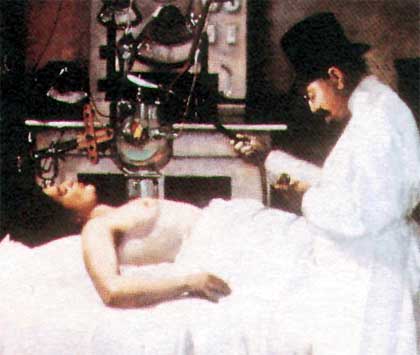
Nel 1908 il Dr. Chicolot dipingeva i primi tentativi di trattamento del cancro con Raggi X.
Il ruolo che la radioterapia svolge nella cura dei tumori o in alcune manifestazioni della malattia tumorale, come il dolore, coinvolge approssimativamente il 60% di tutti i pazienti ammalati di cancro. La radioterapia può essere usata in alcune forme tumorali o in alcuni stadi di esse come terapia esclusiva, cui può conseguire la guarigione, oppure può integrarsi con chirurgia e chemioterapia per conseguire lo stesso risultato. In caso di dolore , soprattutto se dovuto alla presenza del tumore diffuso allo scheletro, la radioterapia può essere ritenuta l' analgesico più efficace e dare un notevole contributo al miglioramento della qualità di vita del paziente.
Le due anime della radioterapia, quella clinica e quella tecnica, strettamente fuse, pur essendo la parte tecnologica al servizio di quella clinica, rappresentano un binomio di grande interesse nella medicina moderna per la cura del paziente affetto dal cancro.
 Distretto testa-collo ©WB Saunders - The Curtis Center - reprinted with permission | ||
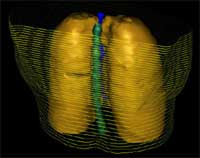 Distretto toracico (in giallo polmoni, in verde midollo spinale, in blu esofago) |
| |